飼料中のダイオキシン類の定量法暫定ガイドラインの全面改訂について
16消安第5299号
平成16年11月24日
平成16年11月24日
農林水産省消費・安全局衛生管理課長
飼料中のダイオキシン類の定量法暫定ガイドラインの全面改訂について
今般、「飼料中のダイオキシン類の定量法暫定ガイドライン」を全面的に改訂したので、御了知の上、検査・試験業務の適正かつ円滑な実施につき万全を期されたい。
これに伴い、従来の「飼料中のダイオキシン類の定量法暫定ガイドライン」(平成15年6月26日付け15生畜第1725号農林水産省生産局畜産部飼料課長通知)は廃止したので、併せて御了知願いたい。
別紙
飼料中のダイオキシン類の定量法暫定ガイドライン
目次
| 第一章 概論 | 1 |
| はじめに | 1 |
| 1. 分析対象 | 1 |
| 2. 用語・略語の定義 | 1 |
| 3. 目標定量下限値 | 2 |
| 4. 分析方法 | 3 |
| 4.1 概要 | 3 |
| 4.2 分析方法の要件 | 3 |
| 第二章 各論 | 5 |
| 第1節 試料採取 | 5 |
| 1. 試料採取(サンプリング) | 5 |
| 2. 試料の処理 | 5 |
| 3. 分析に使用する試料量 | 5 |
| 第2節 分析方法 | 6 |
| 1. 試薬及び標準物質 | 6 |
| 2. 器具及び装置 | 8 |
| 2.1 前処理用器具 | 8 |
| 2.2 ガスクロマトグラフ質量分析装置(GC/MS) | 9 |
| 3. 試料の前処理 | 9 |
| 3.1 抽出及び分解 | 10 |
| 3.1.1 ソックスレー抽出 | 10 |
| 3.1.2 アルカリ分解/ヘキサン抽出 | 11 |
| 3.1.3 高速溶媒抽出 | 11 |
| 3.2 精製及び分画 | 12 |
| 3.2.1 硫酸処理 | 12 |
| 3.2.2 多層シリカゲルカラムクロマトグラフィー | 12 |
| 3.2.3 活性炭シリカゲルカラムクロマトグラフィー | 13 |
| 3.2.4 シリカゲルカラムクロマトグラフィー | 13 |
| 3.2.5 硝酸銀シリカゲルカラムクロマトグラフィー | 13 |
| 3.2.6 DMSO抽出/ヘキサン逆抽出 | 13 |
| 3.2.7 アルミナカラムクロマトグラフィー | 14 |
| 3.2.8 活性炭カラム高速液体クロマトグラフィー(HPLC) | 14 |
| 3.2.9 活性炭シリカゲルカートリッジカラムクロマトグラフィー | 14 |
| 3.3 試料溶液の調製とシリンジスパイク用内標準物質の添加 | 15 |
| 4. 同定及び定量 | 15 |
| 4.1 GC/MSの分析条件の設定 | 15 |
| 4.1.1 ガスクロマトグラフ(GC)の操作条件 | 15 |
| 4.1.2 質量分析計(MS)の操作条件 | 17 |
| 4.2 GC/MSの調整 | 19 |
| 4.2.1 ガスクロマトグラフ(GC)の調整 | 19 |
| 4.2.2 質量分析計(MS)の調整 | 19 |
| 4.2.3 GC/MSの感度確認 | 19 |
| 4.3 検量線の作成(RRFとRRFSSの算出) | 19 |
| 4.4 試料の分析 | 21 |
| 4.4.1 検量線の確認 | 21 |
| 4.4.2 試料の同定と定量 | 21 |
| 4.4.3 回収率の算出 | 22 |
| 5. 数値の取扱い | 22 |
| 5.1 濃度の表示 | 22 |
| 5.1.1 濃度の算出 | 22 |
| 5.1.2 毒性当量への換算 | 23 |
| 6. 表示方法 | 24 |
| 第3節 測定データの品質管理 | 27 |
| 1. 標準作業手順(SOP)の作成 | 28 |
| 2. 分析法バリデーション | 28 |
| 2.1 クリーンアップ操作の評価 | 28 |
| 2.2 回収率の評価 | 28 |
| 2.3 ブランク値の評価 | 28 |
| 2.4 標準試料の分析による真度の確認 | 28 |
| 2.5 定量下限値の評価 | 28 |
| 3. 分析時の信頼性の確認 | 28 |
| 3.1 装置の信頼性 | 28 |
| 3.1.1 装置感度の確認 | 28 |
| 3.1.2 検量線(RRF)の確認 | 29 |
| 3.1.3 注入量の確認 | 29 |
| 3.2 測定値の信頼性 | 29 |
| 3.2.1 ブランク値の評価 | 29 |
| 3.2.2 回収率の評価 | 29 |
| 3.2.3 定量下限値の評価 | 29 |
| 4. データの管理及び評価 | 29 |
| 4.1 異常値、欠測値の取扱い | 29 |
| 4.2 分析の信頼性に関する記録 | 30 |
| 5. 内部精度管理 | 30 |
| 5.1 ブランク値の測定 | 30 |
| 5.2 二重測定 | 30 |
| 5.3 品質管理チェック試料の測定 | 30 |
| 6. 外部精度管理 | 30 |
| 第4節 安全管理 | 31 |
| 1. 施設 | 31 |
| 2. 実験室等の立入規制 | 31 |
| 3. 換気システム | 31 |
| 4. その他の設備 | 31 |
| 5. 実験室内での業務 | 32 |
| 6. 標準物質の取扱い | 32 |
| 7. 試料の取扱い | 32 |
| 8. 実験中の事故の処置 | 32 |
| 9. 廃棄物の保管処分等 | 32 |
| 10. 作業記録 | 33 |
| 11. 健康診断 | 33 |
第一章 概論
はじめに
本ガイドラインは、飼料に係るダイオキシン類の検査の信頼性を確保するため、既存の知見を踏まえ、一般的な技術手法を示したものである。
また、今後、科学的知見の集積等によって、本ガイドラインの改定があり得るものである。
1. 分析対象
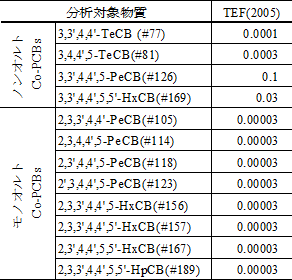
本ガイドラインでは、飼料中のダイオキシン類、すなわちポリ塩化ジベンゾ‐パラ‐ジオキシン(PCDDs)、ポリ塩化ジベンゾフラン(PCDFs)及びコプラナーポリ塩化ビフェニル(Co-PCBs)を分析する。特に、毒性等価係数の定められた PCDDs(7物質)、PCDFs(10物質)及び Co-PCBs(12物質)を以下、「分析対象物質」という。
2. 用語・略語の定義
| ダイオキシン類 | : | ポリ塩化ジベンゾ‐パラ‐ジオキシン(PCDDs)、ポリ塩化ジベンゾフラン(PCDFs)及びコプラナーポリ塩化ビフェニル(Co-PCBs)を合わせた総称。 | ||||
| 異 性 体 | : | 異性の関係にある化合物。ここでは、同一の化学式を持ち、塩素の置換位置が異なった化合物を指す(Isomer)。 | ||||
| 同 族 体 | : | 同族列に属する塩素の置換数又は置換位置を異にする一群の化合物で、ここでは、四~八塩化物を指す(Congener)。 | ||||
| PCDDs | : | ポリ塩化ジベンゾ‐パラ‐ジオキシン(Polychlorinated dibenzo-p-dioxins) | ||||
| PCDFs | : | ポリ塩化ジベンゾフラン(Polychlorinated dibenzofurans) | ||||
| PCDD/DFs | : | ポリ塩化ジベンゾ‐パラ‐ジオキシン及びポリ塩化ジベンゾフラン | ||||
| PCBs | : | ポリ塩化ビフェニル(Polychlorinated biphenyls) | ||||
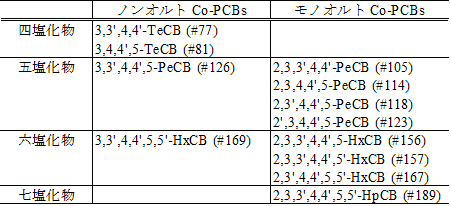
| Co-PCBs | : | 共平面構造をとるポリ塩化ビフェニル(Coplanar-PCBs)。ここでは、毒性等価係数が与えられている 12種類の化合物、すなわち、オルト位(2,2',6及び 6')に置換塩素を持たない(ノンオルト | : | non-ortho)4種類の化合物及びオルト位に置換塩素を 1個もつ(モノオルト | : | mono-ortho)8種類の化合物を示す。 |
| TeCDDs | : | 四塩化ジベンゾ‐パラ‐ジオキシン(Tetrachlorodibenzo-p-dioxins) | ||||
| PeCDDs | : | 五塩化ジベンゾ‐パラ‐ジオキシン(Pentachlorodibenzo-p-dioxins) | ||||
| HxCDDs | : | 六塩化ジベンゾ‐パラ‐ジオキシン(Hexachlorodibenzo-p-dioxins) | ||||
| HpCDDs | : | 七塩化ジベンゾ‐パラ‐ジオキシン(Heptachlorodibenzo-p-dioxins) | ||||
| OCDD | : | 八塩化ジベンゾ‐パラ‐ジオキシン(Octachlorodibenzo-p-dioxin) | ||||
| TeCDFs | : | 四塩化ジベンゾフラン(Tetrachlorodibenzofurans) | ||||
| PeCDFs | : | 五塩化ジベンゾフラン(Pentachlorodibenzofurans) | ||||
| HxCDFs | : | 六塩化ジベンゾフラン(Hexachlorodibenzofurans) | ||||
| HpCDFs | : | 七塩化ジベンゾフラン(Heptachlorodibenzofurans) | ||||
| OCDF | : | 八塩化ジベンゾフラン(Octachlorodibenzofuran) | ||||
| TeCBs | : | 四塩化ビフェニル(Tetrachlorobiphenyls) | ||||
| PeCBs | : | 五塩化ビフェニル(Pentachlorobiphenyls) | ||||
| HxCBs | : | 六塩化ビフェニル(Hexachlorobiphenyls) | ||||
| HpCBs | : | 七塩化ビフェニル(Heptachlorobiphenyls) | ||||
| PFK | : | ペルフルオロケロセン(Perfluorokerosenes) | ||||
| TEF | : | 毒性等価係数(2,3,7,8-TeCDD Toxicity Equivalency Factor) | ||||
| TEQ | : | 毒性当量(2,3,7,8-TeCDD Toxicity Equivalent Quantity) | ||||
| HRGC | : | 高分解能ガスクロマトグラフィー(High Resolution Gas Chromatography)又は高分解能ガスクロマトグラフ(High Resolution Gas Chromatograph) | ||||
| HRMS | : | 高分解能質量分析法(High Resolution Mass Spectrometry)又は高分解能質量分析計(High Resolution Mass Spectrometer) | ||||
| SIM | : | 選択イオン検出(Selected Ion Monitoring) | ||||
| RRF | : | 相対感度係数(Relative Response Factor) |
3. 目標定量下限値
本ガイドラインにおいては、定量下限や操作ブランク値等の許容性を判断する基準として、「目標定量下限値」を導入した。目標定量下限値は、分析の目的、試料の種類及び採取可能な試料量等に照らして決定されるが、本ガイドラインにおいては原則として、表 1-1に示すとおりとした。

4. 分析方法
4.1 概要
飼料中のダイオキシン類の分析には、①抽出、②精製及び分画、③同定及び定量の各工程が含まれる。
各工程にはいくつかの方法があるが、本ガイドラインには、4.2 分析方法の要件を満たすことを確認した方法の一つを示す。本ガイドラインに示す以外の方法であっても、4.2 分析方法の要件を満たすことが確認されれば、分析者はその方法を使用することができる。
4.2 分析方法の要件
新規に開発され、又は、本ガイドラインには採用されていないが一般に用いられている方法で、実証試験を行い本ガイドラインに示した分析方法と同等あるいはそれ以上の性能を有すると認められた方法は、有効に活用することができる。その際、少なくとも以下に示す事項について十分に検討し、本ガイドラインに示す分析精度が確保される必要がある。
さらに、複数の機関による検証試験が実施され、ダイオキシン類に対する分析方法として充実されていくことが望ましい。
① 前処理(抽出及び分解)
a) 様々な飼料の種類等に応じて抽出効率が安定した方法であるか。
② 前処理(精製及び分画)
a) 試薬・器具のブランク値は低いか。
b) 各クロマトグラフィーの溶出画分は安定しているか。
c) 実試料で検出される可能性のある妨害成分を、確実かつ効果的に分離・除去できるか。
③ GC/MS分析
a) 分析対象物質の異性体特異分析(Isomer specific analysis)を行うことができるか。
b) キャピラリーカラムの異性体分離能は良いか。
c) 試料の濃度範囲と定量可能範囲(検量線)とが一致しているか。
d) 装置の定量下限値は目標定量下限値を達成できるか。
e) 装置の感度の変動(ドリフト)が十分少ないか。
f) 高分解能質量分析計(HRMS)の分解能(M/M, 10%谷)が 10,000以上であるか。
④ 同定・定量
a) 操作ブランク値が十分低いか。
b) 定量下限値は、目標定量下限値と同等か。
c) 同一試料についての再現性があるか。
⑤ 分析法の性能
a) 添加したクリーンアップスパイク用内標準物質の回収率は 40~120%か。
b) 標準試料注1が正しく分析できるか。
第二章 各論
第1節 試料採取
1. 試料採取(サンプリング)
試料採取にあたっては、検査対象の大きさ、抽出個数又は箇所数、一次試料の採取方法及び縮分方法は原則として、「飼料等検査実施要領の制定について」(昭和52年 5月10日付け 52畜 B第 793号畜産局長通達)の別記「飼料等の収去等の方法」に従うこととする。また、外部(採取実施者を含む。)及び採取用器具からのダイオキシン類の混入のないように留意すること。
2. 試料の処理
採取後の試料は、ダイオキシン類の外部からの混入や分解等を防ぐため、密封・遮光できる容器に入れ、保管・運搬する。
分析試料の調製法は原則として、「飼料分析基準の制定について」(平成20年4月1日付け19消安第14729号農林水産省消費・安全局長通知)の「第2章 分析用試料の調製法等」に従う注2。
また、分析に用いた試料の残りを長期間保存する場合は、必要に応じて冷凍又は冷蔵保存する。
3. 分析に使用する試料量
第一章表 1-1に示す目標定量下限値を得るためには、GC/MSの定量下限量を四塩化物で 0.1 pg、最終試料溶液量を 50 µL、GC/MSへの注入量を 1 µLとした場合、分析に使用する試料量は、100 g程度が目安となる(表2-1)。飼料の種類によって、当該試料採取量では目標定量下限値を得ることが困難な場合や、更に低い定量下限値を得るためには、試料量を増やすことにより対応する。
表 2-1 分析に使用する試料量の目安

第2節 分析方法
1. 試薬及び標準物質
分析に用いる試薬はブランク試験(第3節参照)を行い、ダイオキシン類の分析に影響を及ぼす妨害成分が含まれていないことを確認してから使用する。
1) へキサン、エタノール、アセトン、トルエン、ジクロロメタン
ダイオキシン類分析用注3、残留農薬試験用又は PCB分析用のもの。分析時の濃縮倍数に応じて濃縮したもの 1 µLを GC/MSに注入したとき、ダイオキシン類の標準物質及び内標準物質のクロマトグラムに妨害を生じないもの。
2) ノナン、デカン、イソオクタン
ダイオキシン類分析用注3、市販の試薬特級又はこれと同等以上のもの。分析時の濃縮倍数に応じて濃縮したもの 1 µLを、GC/MSに注入したとき、ダイオキシン類の標準物質及び内標準物質のクロマトグラムに妨害を生じないもので、分析に支障をきたさないもの。
3) へキサン洗浄水
蒸留水をへキサンで十分に洗浄し、分析に支障をきたさないもの。
4) 硫酸
市販の試薬特級又は同等以上のもので、分析に支障をきたさないもの。
5) ヘキサン洗浄ジメチルスルホキシド(以下、「DMSO」という。)
市販の試薬特級又は同等以上のジメチルスルホキシドをヘキサンで十分に洗浄し、分析に支障をきたさないもの。
6) 硫酸ナトリウム(無水)
ダイオキシン類分析用注3、残留農薬試験用又はPCB 分析用のもので、分析に支障をきたさないもの。
7) 水酸化カリウム、硝酸銀、塩化ナトリウム
市販の試薬特級又は同等以上のもので、分析に支障をきたさないもの。
8) シリカゲル
カラムクロマトグラフィー用シリカゲル(PCB分析用、粒径0.063~0.200 mm)注4。必要に応じて以下により活性化する。
シリカゲルをカラム管にメタノールを用いて湿式充てんした後、2倍重量のメタノールを流す。次に内容物を取り出し、ロータリーエバポレーターで完全にメタノールを留去した後、ビーカーに入れ層の厚さを 10 mm以下にして、130°Cで約 18時間乾燥して活性化した後、デシケーター中で 30分間放冷する。
9) 2%水酸化カリウム被覆シリカゲル(以下、「2%水酸化カリウムシリカゲル」という。)
メタノール洗浄済みシリカゲル 100 gに、水酸化カリウム溶液(50 g/L)40 mLを加え、ロータリーエバポレーターで約 50°Cで減圧脱水し、水分のほとんどが除去された後、80°Cでさらに 1時間脱水を続けて粉末状にしたもの注5。調製後、密閉できる試薬瓶に入れデシケーター中に保存する。
10) 22%硫酸被覆シリカゲル(以下、「22%硫酸シリカゲル」という。)
メタノール洗浄済みシリカゲル 100 gに、硫酸を 28.2 g添加後、十分振とうし粉末状にしたもの注5。調製後、密閉できる試薬瓶に入れ、デシケーター中に保存する。
11) 44%硫酸被覆シリカゲル(以下、「44%硫酸シリカゲル」という。)
メタノール洗浄済みシリカゲル 100 gに、硫酸を 78.6 g添加後、十分振とうし粉末状にしたもの注5。調製後、密閉できる試薬瓶に入れ、デシケーター中に保存する。
12) 10%硝酸銀被覆シリカゲル(以下、「10%硝酸銀シリカゲル」という。)
未洗浄のシリカゲル 1 g当たり 40%硝酸銀溶液を 0.25 mL加えた後、振とう機でよく混合し、130°Cで約 3時間乾燥して活性化したもの注5。調製後、密閉できる褐色瓶に入れ、デシケーター中に保存する。
13) 活性炭シリカゲル
市販のダイオキシン類分析用又は同等以上のもので、妨害物質の溶出等分析に支障をきたさないもの。事前にカラムの溶出条件を確認すること注6。
14) アルミナ
カラムクロマトグラフィー用アルミナ(中性又は塩基性、活性度Ⅰ、粒径 0.063~0.200 mm)。以下により活性し、事前にカラムの溶出条件を確認すること注7。
シャーレ又はビーカーに厚さ 10 mm以下になるように入れ、130°Cで 18時間乾燥又は 500°Cで約 8時間加熱処理した後、デシケーター中で室温まで放冷する。
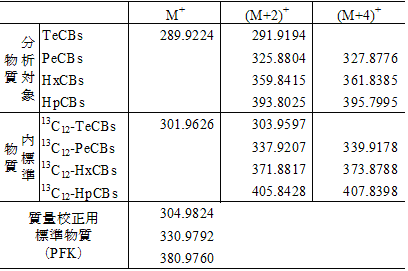
15) 標準物質注8
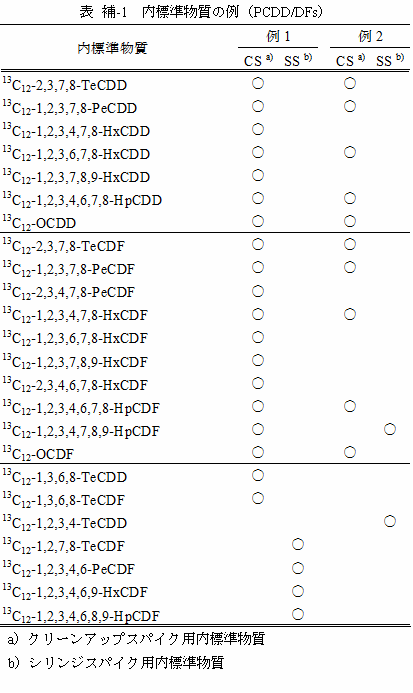
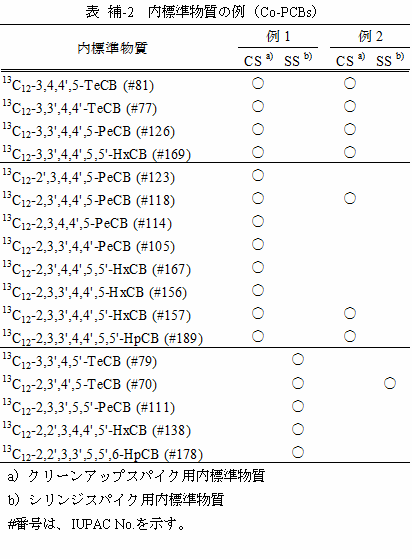
ダイオキシン類の同定及び定量に用いる標準物質を表 2-2及び表 2-3に示す。
16) 標準液
市販の混合溶液注9を用いて検量線の濃度範囲に応じてノナン等注10で希釈したものを用意する。
17)内標準物質注8
全ての炭素原子又は塩素原子が 13C又は 37Clで標識された PCDDs、PCDFs及び Co-PCBsをクリーンアップスパイク用及びシリンジスパイク用に用いる注11。表2-2 及び表2-3 参照。
18)内標準液
市販の混合溶液注9を用いて、内標準物質として添加する量及び検量線の濃度範囲に応じて、ノナン等注10で希釈したものを用意する。
表 2-2 PCDD/DFsの標準物質
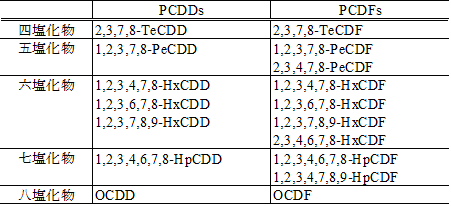
表 2-3 Co-PCBs の標準物質
#番号は、IUPAC No.を示す。
2. 器具及び装置
分析に用いる器具(試料の保管、輸送用容器を含む)は専用のものを用い、アセトン及びヘキサン等で、よく洗浄したものを使用する。特に前の試料からの汚染が懸念される場合には、ブランク試験(第3節参照)を行い、ダイオキシン類の分析に影響を及ぼす妨害成分が含まれていないことを確認してから使用する。
2.1 前処理用器具
すり合わせの部分にはグリースを使用してはならない注12。
1)一般的な分析器具
分液漏斗、ソックスレー抽出器等
2)濃縮器
クデルナ・ダニッシュ(KD)濃縮器又はロータリーエバポレーターを使用する。
2.2 ガスクロマトグラフ質量分析装置(GC/MS)
二重収束型の質量分析計を用いる高分解能ガスクロマトグラフ質量分析計(HRGC/HRMS)
1)カラム恒温槽
恒温槽の温度制御範囲が 50~350°Cであり、分析対象物質の最適分離条件の温度にできるような昇温プログラムの可能なもの。
2)キャピラリーカラム
内径 0.25~0.32 mm、長さ 25~60 mの溶融シリカ製のものであって、内面に液相をコーティングしたもの注13。
3)検出器(MS)
二重収束型のもので、分解能(M/M, 10%谷)10,000以上の高分解能で分析できるもの。
イオン源は、温度を 160~350°Cに保つことができ、電子イオン化法(以下、「EI法」という。)が可能で、電子エネルギーが 25~70 eV程度のもの。
検出法として、SIM法で定量できるもので、SIM法における周期を、最大 1秒以下にでき、ロックマス方式が可能なもの。
4)試料導入部
試料の全量を再現性良く導入できるもの(スプリットレス又はオンカラム方式)。
250~280°Cにできること。
5)キャリアーガス
高純度ヘリウム(純度 99.999%以上)。
3. 試料の前処理
飼料中のダイオキシン類の定量の前処理において、ダイオキシン類の抽出法は試料の種類により 2通りの方法に大別される(図 2)。
畜産動物用配合飼料、乾牧草、植物質性原料等、脂質含有量が比較的少ない試料については、ソックスレー抽出又は高速溶媒抽出によりダイオキシン類を抽出し、硫酸処理により有機物を分解する(3.1.1 ソックスレー抽出又は3.1.3 高速溶媒抽出、3.2.1 硫酸処理)。
養殖水産動物用配合飼料、動物質性原料、油脂類等はアルカリ分解により脂質を分解した後、ヘキサンによりダイオキシン類を抽出する(3.1.2 アルカリ分解/ヘキサン抽出)。
抽出及び分解処理した試料溶液を、多層シリカゲルカラムクロマトグラフィー(3.2.2)により精製し、更に活性炭シリカゲルカラムクロマトグラフィー(3.2.3)により精製及び分画した後、試料溶液を濃縮(3.3)し GC/MS測定に供する(図 2)。
本ガイドラインに示す前処理では抽出又は精製が不十分である場合には、適宜抽出法を検討するか、必要な精製工程を追加することで対応する。
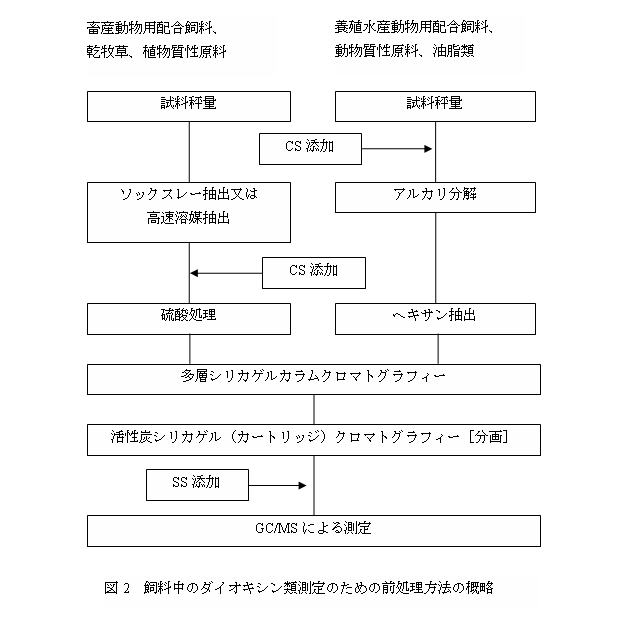
3.1 抽出及び分解
3.1.1 ソックスレー抽出
3.1.1.1 ソックスレー抽出
試料注14 50~100 gを円筒ろ紙注15に入れ、ソックスレー抽出管に装着する。トルエンを入れたソックスレー受器の上部に抽出管、ディーンスタークアダプタ注16及び冷却管を順次接続し、16時間以上の抽出を行う。試料容量が大きくなる場合には、ソックスレー抽出管数本に試料を分割して抽出を行う。
3.1.1.2 クリーンアップスパイク用内標準物質の添加
抽出液にPCDD/DFsについては、少なくとも各塩素数につき 13C又は 37Clで標識された 2,3,7,8-位塩素置換異性体を最低 1種類ずつ、Co-PCBsについては、4種類のノンオルト Co-PCBs及び各塩素数につき最低 1種類ずつのモノオルト Co-PCBsの 13Cで標識された塩素置換体を内標準物質として添加する。内標準物質の添加量は、GC/MS試料溶液中の濃度が検量線作成用標準液と同程度の濃度になるようにする。通常は GC/MS試料溶液中のダイオキシン類が、1~20 ng/mLとなるように添加する。この抽出液を減圧濃縮し、試料を分割していた場合は 1つに合わせ、更にほとんど乾固するまで減圧濃縮する。残留物をヘキサン約 100 mLに溶解させ 500 mLの分液漏斗に移す注17。
3.1.2 アルカリ分解/ヘキサン抽出
3.1.2.1 クリーンアップスパイク用内標準物質の添加
試料 25~50 g(油脂類は10~15 g)を 1 Lのトールビーカーに量り採り、これにエタノール 50 mLを加え、必要ならば高速ホモジナイザー注18で撹はん後、3.1.1.2と同様にトールビーカーにクリーンアップスパイク用内標準物質を添加する。
3.1.2.2 アルカリ分解
トールビーカーにエタノール 250 mL及び 10 mol/L水酸化カリウム溶液 50 mLを徐々に加え、室温でマグネチックスターラーにより穏やかに 2時間撹はんする注19。
3.1.2.3 ヘキサン抽出
アルカリ分解液を 1 Lの分液漏斗に移す。これにヘキサン洗浄水 100 mL、ヘキサン 100 mLを加え振とう抽出する。静置後ヘキサン層を分取し、水層にヘキサン 100 mLを加え同様の操作を更に 2~3回繰り返す。
ヘキサン抽出液を合わせ、2%塩化ナトリウム水溶液 150 mLを加えて回転するように緩やかに揺り動かし、静置後水層を取り除き、同様の操作を更に 2~3回繰り返す注20。
ヘキサン層を硫酸ナトリウム(無水)で脱水する。
3.1.3 高速溶媒抽出注21
3.1.3.1 高速溶媒抽出
試料注14 50 gを抽出容器注22に入れ、高速溶媒抽出装置注23に装着し、抽出を行う。試料容量が大きくなる場合には、抽出容器注24数本に試料を分割して抽出を行う。
抽出条件 例
抽出溶媒:ヘキサン-アセトン(1+1)
温度:100℃
加熱時間:5分
圧力:10.3 MPa注25
保持時間:5分
保持回数注26:3
溶媒置換総量注27:抽出容器の60%
窒素ガスパージ時間:120~150秒
3.1.3.2 クリーンアップスパイク用内標準物質の添加
3.1.1.2と同様にクリーンアップスパイク用内標準物質を抽出液に添加する注28。この抽出液を1 Lの分液漏斗に移す。試料を分割していた場合は複数の抽出液を先の分液漏斗に合わせる。捕集ビンを少量のヘキサンで数回洗浄し、洗液を先の分液漏斗に合わせる。分液漏斗のヘキサン量が200 mL程度となるようにヘキサンを加え、更にアセトン量が150 mL程度となるようにアセトンを加える注29。2%塩化ナトリウム水溶液150 mLを加えて振り混ぜ注29、静置後水層を取り除く。更に、2%塩化ナトリウム水溶液150 mLを加えて回転するように緩やかに揺り動かし注30、静置後水層を取り除く。
3.2 精製及び分画注31
抽出及び分解により得た試料溶液を硫酸処理(3.2.1)及び多層シリカゲルカラムクロマトグラフィー(3.2.2)により精製し、活性炭シリカゲルカラムクロマトグラフィー(3.2.3)によりモノオルト Co-PCBs画分、ノンオルト Co-PCBs画分及び PCDD/DFs画分に分画する。なお、アルカリ分解/ヘキサン抽出により試料溶液を得た場合は、通常、硫酸処理を省略して差し支えない。
以上の操作では精製が不十分である場合は、3.2.3以降に示す精製法を適宜追加することができる。
3.2.1 硫酸処理
試料溶液の入っている分液漏斗に濃硫酸を適量加え、穏やかに振とうし、静置後、硫酸層を除去する。この操作を硫酸層がほとんど着色しなくなるまで繰り返す注32。ヘキサン層をヘキサン洗浄水 50~100 mLで 3~5回洗浄し、硫酸ナトリウム(無水)で脱水する。
3.2.2 多層シリカゲルカラムクロマトグラフィー
内径 15 mm、長さ 300 mmのカラム管に、シリカゲル 0.9 g、2%水酸化カリウムシリカゲル 3.0 g、シリカゲル 0.9 g、44%硫酸シリカゲル 4.5 g、22%硫酸シリカゲル 6.0 g、シリカゲル 0.9 g、10%硝酸銀シリカゲル 3.0 g、シリカゲル 2.0 g注33及び硫酸ナトリウム(無水) 6.0 gを順次乾式充てんする注34。
へキサンでカラムを十分洗浄し、液面がカラムの上面に達するまで流下させた後、5 mL程度に減圧濃縮した試料溶液を入れる。少量のヘキサンで数回洗い込み、ヘキサン 150~200 mLを滴下速度約 2.5 mL/min(毎秒 1滴程度)で流し、ダイオキシン類を溶出させる注35。
3.2.3 活性炭シリカゲルカラムクロマトグラフィー
カラム管(内径 7~10 mm、長さ ~300 mm)に、硫酸ナトリウム(無水) 3.0 g、活性炭シリカゲル 1.0 g及び硫酸ナトリウム(無水) 3.0 gを順次乾式充てんする。
0.5 mL程度に減圧濃縮した試料溶液を入れる。容器をヘキサン 0.5 mL程度注36で洗浄し、洗液を活性炭シリカゲルカラムに加える。この操作を更に 1回繰り返す。15分間放置した後、ヘキサン 50 mLを滴下速度約 2.5 mL/min(毎秒 1滴程度)で流し、液面がカラムの上面に達するまで流下し、カラムを洗浄する。
次いでヘキサン―ジクロロメタン(3+1) 60 mLを滴下速度約 2.5 mL/min(毎秒 1滴程度)で流し、液面がカラムの上面に達するまで流下し、モノオルト Co-PCBs画分を得る。
次いでヘキサン―トルエン(3+1) 25 mLを滴下速度約 2.5 mL/min(毎秒 1滴程度)で流し、液面がカラムの上面に達するまで流下し、ノンオルト Co-PCB画分を得る。
次いでトルエン 300 mLを滴下速度約 2.5 mL/min(毎秒 1滴程度)で流し、PCDD/DFs画分を得る。
3.2.4 シリカゲルカラムクロマトグラフィー注37
カラム管(内径 7~15 mm、長さ ~300 mm)にシリカゲル 3 gをへキサンで充てんし、その上に硫酸ナトリウム(無水)を約 10 mm積層する。
へキサンでカラムを十分洗浄し、液面がカラムの上面に達するまで流下させた後、5 mL程度に減圧濃縮した試料溶液を入れる。少量のへキサンで数回洗い込み、液面がカラムの上面に達するまで流下させ、ヘキサン 150 mLを滴下速度約 2.5 mL/min(毎秒 1滴程度)で流し、ダイオキシン類を溶出させる。
3.2.5 硝酸銀シリカゲルカラムクロマトグラフィー注38
カラム管(内径 7~15 mm、長さ ~300 mm)にシリカゲル 1 g及び 10%硝酸銀シリカゲル 1 gを順次充てんし、その上に硫酸ナトリウム(無水)を約 10 mm積層する。
ヘキサンでカラムを十分洗浄し、液面がカラムの上面に達するまで流下させた後、5 mL程度に減圧濃縮した試料溶液を入れる。少量のヘキサンで数回洗い込み、ヘキサン 200 mLを滴下速度約 2.5 mL/min(毎秒 1滴程度)で流し、ダイオキシン類を溶出させる。
3.2.6 DMSO抽出/ヘキサン逆抽出注39
3.2.6.1 DMSO抽出
5 mL程度に減圧濃縮した試料溶液を 300~500 mLの分液漏斗に入れ、容器をヘキサン 1 mL程度で数回洗浄し、洗液を分液漏斗に合わせる。ヘキサン洗浄 DMSO 25 mLを加えて振とう抽出し、DMSO層を分取する。同様の操作を更に 3回繰り返し、DMSO層を合わせ 300 mLの分液漏斗に移した後、ヘキサン洗浄水 100 mLを加える。
3.2.6.2 ヘキサン逆抽出
DMSO・水層にヘキサン 75 mLを加え振とう抽出し、ヘキサン層を分取し 300~500 mLの分液漏斗に移す。この操作を 2~3回繰り返し、ヘキサン層をヘキサン洗浄水 25 mLで数回洗浄する。ヘキサン層を硫酸ナトリウム(無水)で脱水する。
3.2.7 アルミナカラムクロマトグラフィー注40
カラム管(内径 10~15 mm、長さ 300 mm)にアルミナ 15 gを充てんし、その上に硫酸ナトリウム(無水)を約 10 mm積層する。
ヘキサンでカラムを十分洗浄し、液面がカラムの上面に達するまで流下させた後、5 mL程度に減圧濃縮した試料溶液を移す。少量のヘキサンで数回洗い込み、ヘキサン 150 mLを滴下速度約 2.5 mL/min(毎秒 1滴程度)で流す。
次いで、ヘキサン―ジクロロメタン(49+1) 200 mLを滴下速度約 2.5 mL/min(毎秒 1滴程度)で流す。この画分にはモノオルト Co-PCBsが溶出する。
次いで、ジクロロメタン―ヘキサン(3+2) 200 mLを滴下速度約 2.5 mL/min(毎秒 1滴程度)で流す。この画分にはノンオルト Co-PCBs及び PCDD/DFsが溶出する。
3.2.8 活性炭カラム高速液体クロマトグラフィー(HPLC)
HPLCに活性炭カラム(例、内径4.6 mm、長さ100 mm)注41を装着し、あらかじめトルエンでカラムを十分に洗浄した後、十分量のへキサンで置換する。調製した試料溶液をHPLCカラムに注入し、移動相としてヘキサン 8 mLを流す。
次いでヘキサン―ジクロロメタン(1+1) 40 mLを流し、モノオルト Co-PCBs画分を得る。
次いでヘキサン―トルエン(7+3) 40 mLを流し、ノンオルト Co-PCBs画分を得る。
次いでカラムオーブンを 50°Cに加温し、移動相の流れの向きを逆にし、トルエン 30 mLを流し、PCDD/DFs画分を得る。
3.2.9 活性炭シリカゲルカートリッジカラムクロマトグラフィー
0.5 mL程度に減圧濃縮した試料溶液を活性炭シリカゲルカートリッジ注6に入れる。容器をヘキサン 0.5 mL程度注36で洗浄し、洗液を活性炭シリカゲルカートリッジに加える。この操作を更に 1回繰り返す。15分間放置した後、ヘキサン 60 mLを同カートリッジに加え、液面がカラムの上面に達するまで流下し、カラムを洗浄する。
次いでヘキサン―ジクロロメタン(3+1) 50 mLを同カートリッジに加え、液面がカラムの上面に達するまで流下させ、モノオルト Co-PCBs画分を得る。
次いで、カートリッジを反転させ、トルエン 50 mLを同カートリッジに加え、ノンオルト Co-PCB及びPCDD/DFs画分を得る。
3.3 試料溶液の調製とシリンジスパイク用内標準物質の添加
ダイオキシン類の精製及び分画後に、ダイオキシン類が溶出する各画分を約 1 mLに減圧濃縮する。濃縮液をクデルナ・ダニッシュ(KD)濃縮器に移し、容器をヘキサン 1~2 mLで数回洗浄し、洗液を KD濃縮器に合わせた後、窒素気流下で約 0.1 mL以下まで濃縮する注42。
次いで、シリンジスパイク用内標準物質をクリーンアップスパイク用内標準物質と同程度の濃度になるように加え、少量のヘキサンでKD濃縮器の壁を洗い、更に窒素気流下で極少量の溶媒が残る程度まで濃縮する。次いで、ノナン0.05~0.1 mLを加え、更に窒素気流下で最終液量まで濃縮注42,43し、GC/MS試料溶液とする注44。
4. 同定及び定量
ダイオキシン類の同定と定量はキャピラリーカラムを用いるガスクロマトグラフ(GC)と二重収束型質量分析計(MS)を用いるガスクロマトグラフ質量分析法(GC/MS法)によって行う。
4.1 GC/MSの分析条件の設定
4.1.1 ガスクロマトグラフ(GC)の操作条件
分析対象物質のピークが他の異性体のものと良好に分離し、保持時間が適切な範囲にあり、安定した応答が得られるように、カラム槽温度、注入口温度、キャリアーガス流量等の条件を設定する。以下に GCの設定条件の例を示す。
(1)PCDD/DFs例 1
1)測定対象:TeCDD/DFs及び PeCDFs
使用カラム:SP-2331(内径 0.32 mm、長さ 60 m、膜厚 0.2 µm)
カラム温度:100°C(1.5 min保持)→(20°C/min昇温)→180°C→(3°C/min昇温)→260°C(25 min保持)
試料導入法:スプリットレス(90 s)
注入口温度:260°C
2)測定対象:PeCDDs及び HxCDD/DFs
使用カラム:SP-2331(内径 0.32 mm、長さ 60 m、膜厚 0.2 µm)
カラム温度:100°C(1.5 min保持)→(20°C/min昇温)→210°C→(3°C/min昇温)→260°C(25 min保持)
試料導入法:スプリットレス(90 s)
注入口温度:280°C
3)測定対象:HpCDD/DFs及びOCDD/DF
使用カラム:DB-17(内径 0.32 mm、長さ 30 m、膜厚 0.15 µm)
カラム温度:100°C(1.5 min保持)→(20°C/min昇温)→200°C→(10°C/min昇温)→280°C(5 min保持)
試料導入法:スプリットレス(90 s)
注入口温度:280°C
(2)PCDD/DFs例 2
1)測定対象:TeCD/DFs、PeCDD/DFs及び HxCDD/DFs
使用カラム:SP-2331(内径 0.25 mm、長さ 60 m、膜厚 0.2 µm)
カラム温度:100°C(1 min保持)→(20°C/min昇温)→200°C→(2°C/min昇温)→260°C(25 min保持)
試料導入法:スプリットレス(60 s)
注入口温度:260°C
2)測定対象:HpCDD/DFs及び OCDD/DF
使用カラム:HP-5(内径 0.20 mm、長さ 25 m、膜厚 0.33 µm)
カラム温度:100°C(1 min保持)→(20°C/min昇温)→200°C→(5°C/min昇温)→300°C(15 min保持)
試料導入法:スプリットレス(60 s)
注入口温度:260°C
(3)PCDD/DFs例 3
1)測定対象:TeCDD/DFs~OCDD/DF
使用カラム:SP-2331(内径 0.32 mm、長さ 60 m、膜厚 0.2 µm)
カラム温度:180°C(3 min保持)→(3°C/min昇温)→230°C(3 min保持)→(3°C/min昇温)→260°C(30 min保持)
試料導入法:オンカラム
注入口温度:170°C→(100°C/min昇温)→300°C
2)測定対象:TeCDD/DFs~HxDD/DFs
使用カラム:DB-17(内径 0.32 mm、長さ 30 m、膜厚 0.25 µm)
カラム温度:150°C(3 min保持)→(20°C/min昇温)→200°C→(3°C/min昇温)→280°C(10 min保持)
試料導入法:オンカラム
注入口温度:150°C→(100°C/min昇温)→300°C
(4)Co-PCBs例 1
1)測定対象:Co-PCBs
使用カラム:HT-8(内径 0.22 mm、長さ 50 m、膜厚 0.25 µm)
カラム温度:130°C(1 min保持)→(20°C/min昇温)→220°C→(5°C/min昇温)→320°C(3 min保持)
試料導入法:スプリットレス(90 s)
注入口温度:280°C
(5)Co-PCBs例 2
1)測定対象:Co-PCBs
使用カラム:DB-5MS(内径 0.32 mm、長さ 60 m、膜厚 0.25 µm)
カラム温度:150°C(1 min保持)→(20°C/min昇温)→185°C(3 min保持)→(2°C/min昇温)→245°C(3 min保持)→(6°C/min昇温)→
290°C(10 min保持)
試料導入法:オンカラム
注入口温度:170°C→(100°C/min昇温)→300°C
4.1.2 質量分析計(MS)の操作条件
質量校正用標準物質(PFK)を用いたロックマス方式による選択イオンモニタリング(SIM)による分析を行うために、分解能、電子エネルギー、イオン化電流、イオン源温度、モニターイオン(分析対象物質は各塩素数につき 2以上のモニターイオン、内標準物質は 1以上のモニターイオン及び PFKのモニターイオン)及び SIMの周期注45を設定する。
以下にMSの設定条件の例を示す。
分解能(M/DM, 10%谷):10,000以上
電子エネルギー:25~70 eV
イオン化電流:300~1,000 µA
イオン源温度:260~290°C
モニターイオン質量数:表2-4及び表2-5参照
表 2-4 PCDD/Fsのモニターイオン設定質量数の例
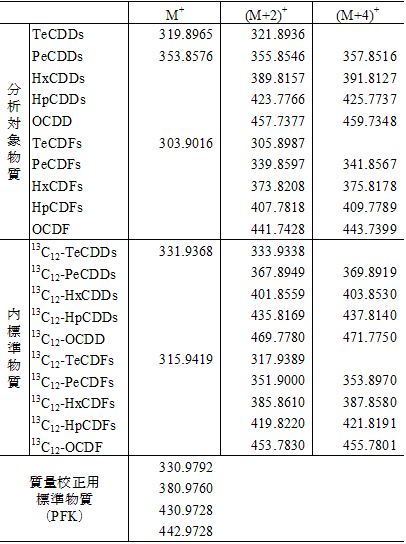
表 2-5 Co-PCBsのモニターイオン設定質量数の例
4.2 GC/MSの調整
測定目的に応じて分析条件を設定し、試料の分析が可能なように調整する。この際、感度、直線性、安定性等のほか、分析の誤差となる干渉の有無の大きさ、その補正法等、十分信頼できる分析ができるかどうか確認しておく。
4.2.1 ガスクロマトグラフ(GC)の調整
応答が安定していること、各塩素置換体の保持時間が適切な範囲にあり、かつ、ピークが十分に分離されていること等を確認する。スプリットレスの時間、パージガス流量等を適切な値に調整する。
キャピラリーカラムの劣化により、分析対象物質と他物質との分離が十分でない場合には、新品と交換する。ただし、キャピラリーカラムを、300 mm程度切断(両端又は片端)することにより、分析対象物質と他物質との分離に問題がなければ交換しなくてもよい。
4.2.2 質量分析計(MS)の調整
MSに PFKを導入し、MSの質量校正用プログラム等により、測定質量範囲内のマスパターン及び分解能(M/DM 10,000以上、10%谷)等の校正を行うとともに、装置の感度等の基本的なチェックを行う。
4.2.3 GC/MSの感度確認
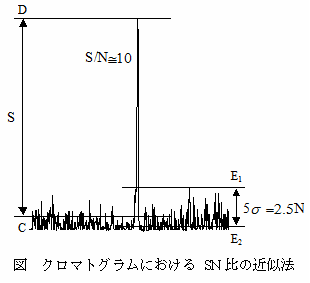
各分析対象物質を注入し SN比(S/N=10)から GC/MSの定量下限量を求める注46。GC/MSの定量下限量から計算した試料における定量下限値が、目標定量下限値を越えないことを確認する(第3節 3.2.3参照)。同様に SN比(S/N=3)から GC/MSの検出下限量及び試料における検出下限値を求める。
4.3 検量線の作成(RRFと RRFSSの算出)
新たに GC/MS装置を導入した場合及び標準溶液を変更した場合には、新たに検量線を作成して、RRF(各分析対象物質とそれに対応するクリーンアップスパイク用内標準物質との相対感度係数)及び RRFSS(各クリーンアップスパイク用内標準物質とそれに対応するシリンジスパイク用内標準物質との相対感度係数)を求める。
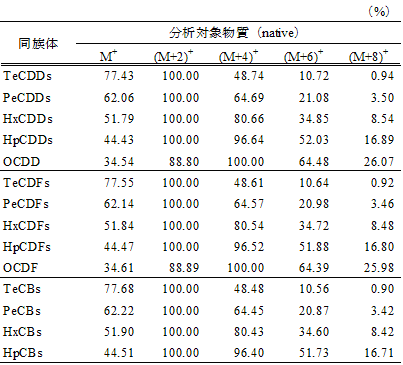
各分析対象物質に対して、0.1 ng/mL~500 ng/mLの濃度範囲で 5段階程度の標準溶液を調製する注47。この標準溶液には、定容前に、あらかじめクリーンアップスパイク及びシリンジスパイクに用いたものと同じ内標準物質を、ダイオキシン類が 1~20 ng/mLなるように添加しておく。標準溶液の 1 µLを GC/MSに注入し、各分析対象物質のクロマトグラムを記録する。各分析対象物質の 2つのモニターイオンのピーク面積の強度比を求め、天然存在比(表 2-6)とほぼ一致することを確認する注48。各分析対象物質の対応するクリーンアップスパイク用内標準物質に対するピーク面積の比と、注入した標準溶液中の各分析対象物質とクリーンアップスパイク用内標準物質の濃度の比を用いて、検量線を作成し、相対感度係数(RRF)を算出する。
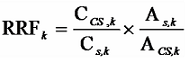
RRFk :分析対象物質 k(以下同様)の相対感度係数
CCS :標準液中のクリーンアップスパイク用内標準物質の濃度
Cs :標準液中の分析対象物質の濃度
As :標準液中の分析対象物質のピーク面積
ACS :標準液中のクリーンアップスパイク用内標準物質のピーク面積
検量線の作成では、1つの濃度に対して、最低 3回の分析を繰り返して行い、全濃度領域では、合計で 15点以上のデータを得る。その平均値を RRFとする。この時のデータの変動係数は 20%以内でなければならない注49。
また、検量線データより、最小二乗法で一次回帰直線を求め、その傾きを RRFとしてもよい。この場合、直線性が十分であるとともに回帰式の切片が限りなく 0に近い必要がある。
同様にして、各クリーンアップスパイク用内標準物質のシリンジスパイク用内標準物質に対する相対感度係数(RRFSS)を次式により算出する。
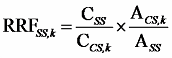
RRFSS, k :クリーンアップスパイク用内標準物質 k(以下同様)の相対感度係数
CSS :標準液中のシリンジスパイク用内標準物質の濃度
CCS :標準液中のクリーンアップスパイク用内標準物質の濃度
ACS :標準液中のクリーンアップスパイク用内標準物質のピーク面積
ASS :標準液中のシリンジスパイク用内標準物質のピーク面積
表 2-6 塩素原子数によるダイオキシン類の同位体ピークの天然存在比
4.4 試料の分析
4.4.1 検量線の確認
測定開始時には、検量線用標準溶液のうち一つ以上を測定して、各分析対象物質とそれに対応するクリーンアップスパイク用内標準物質との相対感度係数(RRF)及びクリーンアップスパイク用内標準物質とそれに対応するシリンジスパイク用内標準物質との相対感度係数(RRFSS)を求め(4.3参照)、検量線作成時の RRF及び RRFSSと比較し、20%以内の変動であることを確認する。これを超えて RRF及び RRFSSが変動する場合はその原因を取り除き、再度検量線用溶液を測定する。さらに保持時間については、比較的短い間に変動(通常、一日に保持時間が ±1%以上、内標準物質との相対保持比が ±0.5%以上)する場合には、その原因を取り除き、再度検量線用溶液を測定する。
なお、測定開始後は想定される試料溶液中の濃度と同程度の濃度の検量線用標準液を定期的に測定し、上記と同様に RRFと保持時間を確認する。RRFと保持時間が上記の範囲を超えて変動した時は、その原因を取り除き、それ以前の試料の再分析を行う。
4.4.2 試料の同定と定量
操作ブランク及び試料溶液の 1~2 µLを GC/MSに注入して分析を行う。4.1.2で設定した各分析対象物質のクロマトグラムを記録する。測定終了後、個々の試料ごとに、2つのモニターイオンのピーク面積の比を計算する注50。個々の試料ごとにロックマスのモニターチャンネルの確認を行う注51。各分析対象物質とそれに対応するクリーンアップスパイク用内標準物質のピーク面積の比を計算し、あらかじめ 4.3で求めた対応する相対感度係数(RRF)を用いて、次式により試料抽出中の各分析対象物質の量を算出する注48,52。
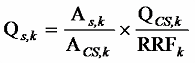
Qs,k :試料抽出液中の分析対象物質 k(以下同様)の量(pg)
As :試料溶液中の分析対象物質のピーク面積
ACS :試料溶液中のクリーンアップスパイク用内標準物質のピーク面積
QCS :試料抽出液に添加したクリーンアップスパイク用内標準物質の量(pg)
RRF :検量線作成時に求めた分析対象物質のクリーンアップスパイク用内標準物質に対する相対感度係数(4.3 参照)
4.4.3 回収率の算出
クリーンアップスパイク用内標準物質のピーク面積とシリンジスパイク用内標準物質のピーク面積の比、及び対応する相対感度係数(RRFSS、4.3参照)を用いて、次式により、回収率を計算し、抽出及びクリーンアップの回収率(Rc)を確認する注53。
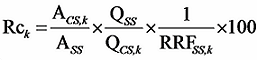
Rck :クリーンアップスパイク用内標準物質 k(以下同様)の回収率(%)
ACS :試料溶液中のクリーンアップスパイク用内標準物質のピーク面積
ASS :試料溶液中のシリンジスパイク用内標準物質のピーク面積
QSS :試料溶液中のシリンジスパイク用内標準物質の添加量(pg)
QCS :試料溶液中のクリーンアップスパイク用内標準物質の添加量(pg)
RRFSS :検量線作成時に求めたクリーンアップスパイク用内標準物質のシリンジスパイク用内標準物質に対する相対感度係数
5. 数値の取扱い
5.1 濃度の表示
5.1.1 濃度の算出
4.4.2で得られた結果から、次式を用いて飼料中のダイオキシン類の濃度を算出する注54。濃度は原則として 3けた目を四捨五入し、有効数字 2けたで表す。ただし、4.2.3で求めた試料における検出下限値の表示けたまでとし、それより下のけたは表示しない。
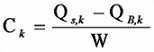
Ck :分析対象物質 k(以下同様)の試料中濃度(pg/g)
Qs :試料抽出液中の分析対象物質の量(pg)
QB :(操作ブランク値がある場合)ブランク試験における試料溶液中の分析対象物質の量(pg)(第3節参照)
W :試料採取量(g)
5.1.2 毒性当量への換算
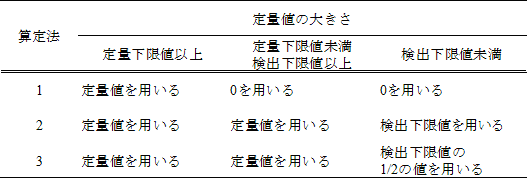
ダイオキシン類の濃度を毒性当量に換算する場合は、5.1.1で算出した各分析対象物質の濃度(pg/g)に表 2-7及び表 2-8に示す毒性等価係数(TEF)を乗じ、その合計を毒性当量(TEQ:pg-TEQ/g)とする。個々の異性体の毒性当量については、丸めの操作は行わず、合計値の 3けた目を四捨五入し、有効数字 2けたで表す。なお、実測濃度が定量下限値未満又は検出下限値未満の場合には表 2-9に示すいずれかの算定法により換算し、いずれの算定法を使用したのかを明記する注55。
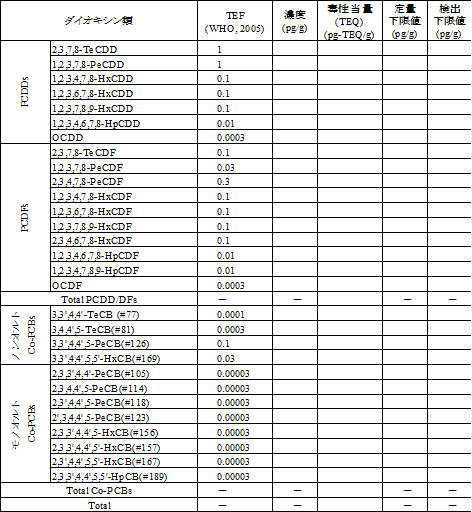
表 2-7 PCDD/DFsの毒性等価係数
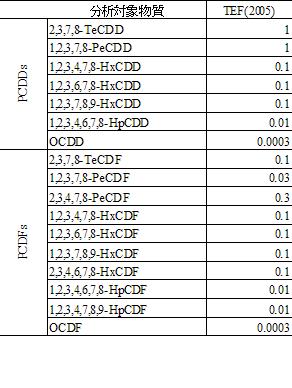
表 2-8 Co-PCBs の毒性等価係数
#番号は、IUPAC No.を示す。
表 2-9 毒性当量の各算定法における定量値の取扱い
6. 表示方法
ダイオキシン類の測定結果の表示方法は次による。
a)PCDD/DFs
PCDD/DFs濃度の測定結果は、表 2-10に示す 2,3,7,8-位塩素置換異性体については表 2-10に、それら以外の四塩化物~七塩化物(TeCDDs~HpCDDs及びTeCDFs~HpCDFs)を分析した場合は同族体の総量を表 2-11に従って表示する。
各分析対象物質の濃度は、定量下限値以上の値はそのまま記載し、定量下限値未満検出下限値以上のものは括弧付きで記載する。更に検出下限値未満のものは、検出しなかったことがわかるように記載する。
表示する定量下限値は各試料について実測した定量下限値、もしくは実測した定量下限値が目標定量下限値より低い場合は目標定量下限値を記載してもよい。
b)Co-PCBs
Co-PCBs濃度の測定結果は、PCDD/DFsと同様に表 2-10に従って表示する。
表 2-10 ダイオキシン類測定結果の表示方法(例)
#番号は、IUPAC No.を示す。
表 2-11 ダイオキシン類同族体総量の表示方法(例)
第3節 測定データの品質管理
ダイオキシン類の分析に当たっては、超高感度分析が要求されるばかりでなく、塩素置換同族体の多数の異性体を分離・定量するので、極めて高度な精度が要求されるため、精度の管理を十分に行う必要がある。図2-3参照。
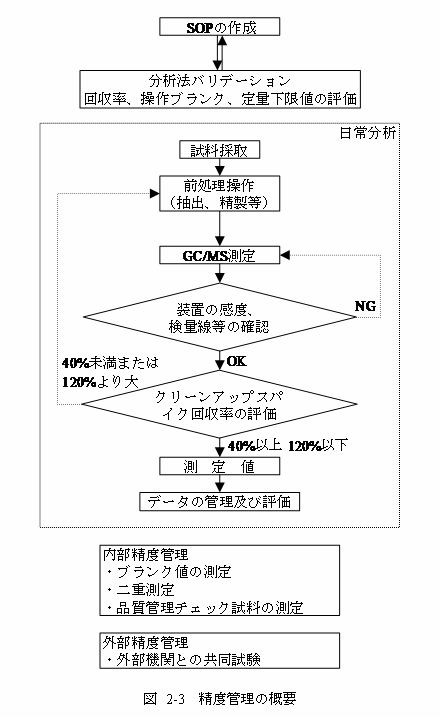
1. 標準作業手順(SOP)の作成
試験機関においては、次の項目等について作業手順を設定しておく。この作業手順は、具体的で分かりやすいこと及び関係者に周知徹底しておくことが必要である。
1)試料採取用器具等の準備、メンテナンス、保管及び取扱方法。
2)前処理用試薬類の準備、精製、保管及び取扱方法。
3)分析用試薬、標準物質等の準備、標準溶液の調製、保管及び取扱方法。
4)分析機器の分析条件の設定、調整、操作手順、維持管理。
5)分析方法全工程の記録(使用するコンピュータのハードウェア及びソフトウェアを含む。)。
2. 分析法バリデーション
新たに分析法を導入した場合及び分析法を変更した場合に実施し、その結果を記録する。
2.1 クリーンアップ操作の評価
カラムクロマトグラフィーにおいて、分画条件は使用する充てん剤の種類や活性度、あるいは溶媒の種類及び量によって異なるので、あらかじめ全分析対象物質を含む標準溶液を用いて、分画試験を行って条件を決めておく。
2.2 回収率の評価
クリーンアップスパイク用内標準物質の回収率を測定する。クリーンアップスパイク用内標準物質の回収率が 40%以上 120%以下であることを確認する(第2節 4.4.3参照)。
2.3 ブランク値の評価注56
ブランク試験を 5回以上繰り返し、ブランク値の平均値と標準偏差を求める。
2.4 標準試料の分析による真度の確認
適当な標準試料注 1を分析して、得られた値が認証値の範囲内であることを確認する。
2.5 定量下限値の評価
2.3でブランク値が認められる化合物においては、ブランク値の標準偏差の 10倍に相当する量を求める。また、クロマトグラム上のノイズと標準溶液から求めたピーク高さから、S/N=10に相当する量を求める注46。この2つの値の大きい方を定量下限値とする。
3. 分析時の信頼性の確認
以下の操作は、分析を行うごとに実施し、その結果を記録する。また、定められた基準が確認できない場合は、原則として再分析を行う。
3.1 装置の信頼性
3.1.1 装置感度の確認
GC/MS操作条件を設定し、適切な調整を行った後、標準溶液を注入し SN比から GC/MSの定量下限量を求める。GC/MSの定量下限量から計算した試料における定量下限値が、目標定量下限値を越えないことを確認して記録する(第2節 4.2.3参照)。
3.1.2 検量線(RRF)の確認
定期的に検量線用標準溶液を分析して、ダイオキシン類の各塩素置換体と内標準物質の相対感度が変動していないことを確認する(第2節 4.3参照)。
3.1.3 注入量の確認
GC/MS測定した試料溶液毎に、シリンジスパイク用内標準物質等のピーク面積から、設定した液量が GC/MSに注入されていることを確認する。
3.2 測定値の信頼性
3.2.1 ブランク値の評価
ブランク値が分析法バリデーション(2.3)で求めた値と同程度であることを確認する。ただし、ブランク値を分析値に影響しないよう十分低くなるように管理している場合は毎回行う必要はない。
3.2.2 回収率の評価
試料溶液中のシリンジスパイクとクリーンアップスパイクの面積比から回収率を求める(第2節 4.4.3参照)。回収率が 40%以上 120%以下の範囲内であることを確認する。
3.2.3 定量下限値の評価
2.3でブランク値が認められる分析対象物質においては、ブランク値の標準偏差の 10倍に相当する量を求める。また、クロマトグラム上のノイズと標準溶液から求めたピーク高さから、S/N=10に相当する量を求める。この 2つの値の大きい方を定量下限値とする。ブランク値が認められない分析対象物質においては後者を定量下限値とする。定量下限値が目標定量下限値を超えないことを確認する。
ダイオキシン類の定量下限値が、目標定量下限値より大きい場合には、機器、器具等をチェックして、目標定量下限値を超えないよう調整する。これに達しない場合は、その旨を検査成績書に明記する。
4. データの管理及び評価
4.1 異常値、欠測値の取扱い
分析機器の感度の変動が大きい場合は、分析値の信頼性に問題があるため、再分析を行うか又は欠測扱いとして、再度試料の採取を行う必要がある。このような問題が起こると、多大な労力、時間、コストがかかるだけでなく、異常値や欠測値が多くなると分析結果全体の評価に影響するため、事前のチェックを十分に行う等、異常値や欠測値を出さないように注意する。また、異常値や欠測値が出た経緯を十分に検討し、記録に残して、以後の再発防止に役立てることが重要である。
4.2 分析の信頼性に関する記録
以下のデータを記録し、整理・保管しておき、測定データの信頼性管理に関する報告の要請があった場合に提出する。
(1)試料の採取方法、保管方法
(2)試料の状況
(3)試料の前処理法
(4)標準物質等のメーカー、製品番号及びロット番号
(5)分析装置の操作条件及び校正結果
(6)検量線の RRF、感度、操作ブランク値、回収率、定量下限値。
5. 内部精度管理
分析環境及び分析操作の総合的な信頼性を確認するため、定期的に以下に示す方法に準じて試験を行う。
5.1 ブランク値の測定
以下に示す事項に該当する場合は、試料の前処理に用いるのと同じ試薬を同じ量用いてブランク試験を行い、2.3で求めたブランク値と同程度であることを確認する。
(1)連続して 10試料の前処理を行った場合
(2)新しい試薬や機器、又は修理した機器を使用するなどの前処理操作に大きな変更があった場合
(3)試料間汚染が予想されるような高い濃度の試料を測定した場合
5.2 二重測定
試料数の 10%程度の頻度で、同一試料を同一条件により 2点並行分析を行い、定量下限値以上の測定値についてその平均値を求め、各定量値と平均値との差がそれぞれ 30%以内であることを確認する。
5.3 品質管理チェック試料の測定
年1回以上、濃度既知の適切な試料を分析し、その結果を記録する。
6. 外部精度管理
外部機関を含めた共同試験に参加し、定量値の信頼性を評価することが望ましい。
第4節 安全管理
1. 施設
標準品の取扱い及び分析操作は、全て管理区域内で行い、当該区域内は陰圧にするなど、外部へのダイオキシン類の放出防止設備が設けられていること。
1)実験室
① 実験室は、専用の実験室とする。
② 実験室は、可能であれば 2~3のエリアに仕切った方がよい。その場合の各エリアの役割は、下記のとおりである。
ア)試料の分解、抽出、精製及び濃縮を行うエリア注57。
イ)ガスクロマトグラフ質量分析装置(GC/MS)による分析を行うエリア。
③ 共用の GC/MSを用いるときは、一定期間をダイオキシン類分析専用とするとともに、本体及び周辺の汚染のないように実験を行う。
2. 実験室等の立入規制
1)実験室への立入りは、関係者に限定する。
2)実験室のドアには、関係者以外立入らないよう表示を行う。
3. 換気システム
1)実験室は、ドラフトチャンバーにより排気を行う。
2)排気された空気は、外部環境汚染防止のため、活性炭フィルター等の処理装置により処理したのち、排出する。
3)給気は、粒子状物質に吸着したダイオキシン類が進入しないよう、フィルター等により管理する。
4)室内汚染防止のため、質量分析計のポンプやガスクロマトグラフの排気部分に、フィルター等を設置する。
4. その他の設備
1)グローブボックス
多量のダイオキシン類を取扱う場合は、グローブボックス内で行う。
2)紫外線ランプ
ダイオキシンの汚染部位を照射するために使用する。
3)排気
GC/MSに付属するすべてのポンプ排気は、ドラフトチャンバーのダクトのように、活性炭フィルター等の処理装置を通じて排気する。
5. 実験室内での業務
1)実験室内では、専用の実験衣及び靴を着用する。
2)作業中は、手袋、安全眼鏡等を着用する。
3)ホールピペット、メスピペット等を使用する際は、安全ピペッター等を使用し、口で吸い上げてはならない。
6. 標準物質の取扱い
1)すべての標準溶液の目録を作成する。
2)すべての標準溶液は、二重栓式試料瓶等に入れ冷蔵庫に保管する。多量の標準物質及び標準溶液は、施錠できる保管庫に保管する。
7. 試料の取扱い
1)濃縮した抽出液は、密閉できるミニ試料瓶等に入れ、冷蔵庫に保管する。
2)長期間の保管が予想されるときは、褐色アンプル中に封入し、破損しないように保護したのち、冷蔵保管する。
3)ダイオキシン類を含む試料を運搬する場合は、万一容器が破損した場合でも、外部に漏れないよう、密閉形のプラスチックコンテナに入れて運ぶ。
8. 実験中の事故の処置
飼料中のダイオキシン類の分析は、取扱量が微量であることから、特段高い危険があるとは考えられないが、実験中の事故等の場合は、実験室を使用する者に連絡するとともに、以下の処置を行う。
1)ダイオキシン類を含む抽出液等を実験中に浴びる等の皮膚接触が起きた時は、直ちに接触部位を石鹸で洗う。
2)実験室内で漏洩事故があった場合は、汚染した部位を、水で湿らせた紙タオルでふき、ついでその部位を、アルコール又はトルエン等の有機溶媒でふき取る。
9. 廃棄物の保管処分等
1)有害固形廃棄物(汚染されたと疑われる手袋、マスク、紙タオル、活性炭フィルター等)は、専用ポリバケツに入れて保管する。
2)有害液体廃棄物(分析プロセス及び器具の洗浄で生じた汚染廃溶媒並びにガスクロマトグラフ質量分析装置の廃オイル等)は、専用の密閉容器に入れて保管する。
3)廃水は、活性炭等により適切に処理した後、排水する。
10. 作業記録
1)実験室立入者の記録をする。
2)作業日報を作成し、分析従事者の作業時間等を記録する。
3)標準溶液は、物質名、数量、濃度、入手先、供与先等を記録し、使用状況も記録する。
4)廃棄物の保管状況や処理状況を記録する。
5)その他必要と考えられる事項を記録する。
11. 健康診断
本ガイドラインに示した分析では、有機溶媒等も使用するため、労働安全衛生法に定められた特定化学物質に係る定期的健康診断を実施すること。ダイオキシン類の影響については、血清中のトリグリセライド、コレステロール等が指標となる。
~注~
1 現在、飼料中のダイオキシン類に関して、標準試料として市販されているものはない。このため、食品等の標準試料を代用するか、品質管理チェック試料により対応する。
2 粉砕して 0.5~1 mmの網ふるいを通してよく混合する。この際、外部から及び試料間のダイオキシン類の混入がないようにすること。
3 ダイオキシン類分析用溶媒及び試薬としては、次のものがある。
アセトン、ジクロロメタン、エタノール、ヘキサン、トルエン、ノナン(関東化学製、和光純薬工業製)及び硫酸ナトリウム(和光純薬工業製)
4 市販のシリカゲルとしては、ワコーゲル S1、ワコーゲルDX(和光純薬工業製)、カラムクロマトグラフィー用シリカゲル(Merck製)、洗浄済みシリカゲル(SUPELCO製)がある。
5市販の各種化学修飾シリカゲルとしては、ダイオキシン類分析用(和光純薬工業、SUPELCO製)がある。
6 市販の活性炭シリカゲルとしては、ダイオキシン類分析用活性炭分散シリカゲル(関東化学製)がある。活性炭シリカゲルカートリッジとしては、活性炭分散シリカゲルリバースカラム(関東化学製)がある。
7 市販のアルミナとしては、ICN Alumina B-Super I(ICN Pharmaceuticals製)がある。
8 分析値は、採取試料と標準物質の分析結果を比較することによって得られるため、分析値の信頼性を確保するためには、可能な限りトレーサビリティの保証された標準物質を用いる必要がある。
9 ダイオキシン類の標準液及び内標準液は、Cambridge Isotope Laboratories(CIL製)(和光純薬工業製)及び Wellington Laboratories(WL製)(関東化学製)より市販されている。
① PCDD/DFs
・検量線作成用標準液として、
DF-CVS-A10(WL製)、EDF-4961(CIL製)、
・クリーンアップスパイク用内標準液として、
DF-LCS-A(WL製)、EDF-4974A(CIL製)、
・シリンジスパイク用内標準液として、
DF-IS-I(WL製)、EDF-4965A(CIL製)
等がある。
② Co-PCBs
PCBは化学物質の審査及び製造等の規制に関する法律(昭和48年10月16日法律第117号)の第 1種特定化学物質に指定されており、購入にあたっては経済産業大臣の許可が必要になるため、入手に 1~2ヵ月を要する。
・検量線作成用標準液として、
DF-CVS-A10(WL製)、EC-4962(CIL製)、
・クリーンアップスパイク用内標準液として、
PCB-LCS-A(WL製)、EC-4969A(CIL製)、
・シリンジスパイク用内標準液として、
PCB-IS-B(WL製)、EC-4970A(CIL製)
等がある。
この他にも多数の製品が販売されており、購入にあたっては各標準液中に含有される異性体及びその濃度を熟知しておく必要がある。
10 デカン又はイソオクタンを用いてもよい。
11 試料または抽出液に添加して前処理の結果を確認し、ダイオキシン類を定量するための基準とするために用いる内標準物質をクリーンアップスパイク用内標準物質という。GC/MS試料溶液に添加して、注入量の確認と、クリーンアップスパイク用内標準物質の回収率を求めるために用いる内標準物質をシリンジスパイク用内標準物質という。クリーンアップスパイク用内標準物質とシリンジスパイク用内標準物質は、それぞれ別の異性体を用いる。内標準物質の使用例を、表 補-1及び表 補-2に示す。
12 ダイオキシン類の吸着を低減するため、透明すり合わせの器具を使用することが望ましい。また同様の理由で、器具の内壁に傷のないものを使用する。
13 カラムブリードが低いカラムを使用する。
① PCDD/DFsの分析では、2,3,7,8-位塩素置換異性体について、それぞれ分離が良好で、更に全ての異性体のクロマトグラム上における溶出順位の判明しているカラムの使用を標準とする。様々な要因を考慮し、2 種以上の極性の異なるキャピラリーカラムの併用が望ましい。SP-2331(Supelco製)、HP-5ms(Agilent製)、DB-5ms(J&W Scientific製)、DB-17ms(J&W Scientific製)等がある。
② Co-PCBsの分析では、12種類全ての異性体について、それぞれ分離が良好で、それらの各異性体のクロマトグラム上における溶出順位の判明しているカラムの使用を標準とする。DB-5ms(J&W Scientific製)、HT-8(SGE製)等がある。
14 湿潤な試料の場合、飼料分析基準に従い予備乾燥するため、採取量は異なる。
15 ガラス又は石英繊維製のもの。使用に先立ちアセトン及びトルエン等で予備洗浄を行う。
16 蒸発後凝結した試料由来の水分を、トルエンとの比重の違いを利用して抽出系から除去するための接続管。飼料においては、試料 100 gあたり 5~20 mL程度の水分が捕集される。
17 ヘキサン 100 mLを数回にわけて受器に加え、器壁を洗いながら分液漏斗に移す。
18 粉砕し 0.5~1 mmのふるいを通過していれば通常必要ない。
19 撹はん後一晩放置すると特に OCDFが分解し回収率が低下する現象が認められる。このため、アルカリ分解及びヘキサン抽出の操作は同日に行った方がよい。
20 必要ならばこの段階で 3.1.1.3に示す硫酸処理を行ってもよい。
21 高圧液体抽出、高圧流体抽出又は加圧流体抽出とも呼ばれている。
22 試料採取後、抽出容器に空間がある場合は、ケイソウ土、ガラスビーズを加えてもよい。ケイソウ土としては、ケムチューブ-ハイドロマトリックス(VARIAN製)及びASE Prep D.E.(DIONEX製)がある。
23 高速溶媒抽出装置としては、ASE-100、ASE-200、ASE-300(DIONEX製)がある。
24 33 mLの抽出容器にはおおよそ10 gの乾牧草又はおおよそ20 gの穀物を入れることができる。また、99 mLの抽出容器にはおおよそ30 gの乾牧草又はおおよそ60 gの穀物を入れることができる。
25 1,500 psi
26 サイクル数
27 保持回数によって、分割して注入される。例えば、「保持回数:3」及び「溶媒置換総量:抽出容器の60%」の場合、高速溶媒抽出装置の動作は、次のとおりである。
最初に、抽出容器内の圧力が10.3MPaになるまで抽出溶媒を注入し、抽出容器内を昇温するために5分間加熱する。次に、5分間保持し、抽出容器の20%の容量の抽出溶媒を同容器に注入し、流出した抽出液を捕集ビンに捕集し、更に、5分間保持及び20%容量の溶媒注入の動作を2回繰り返す。3回目の抽出溶媒注入後直ちに窒素ガスをパージし、流出した抽出液を捕集ビンに捕集する。
28 試料を分割していた場合はいずれか1つの抽出液にクリーンアップスパイク用内標準物質を添加してもよい。
29 溶媒容量割合が大幅に異なるとエマルジョンが発生しやすくなる。
30 振り混ぜるとエマルジョンが発生する。
31 カラムクロマトグラフィーにおいて使用する充てん剤等を大きく変える場合は、標準溶液等を用いて分画試験を行い、充てん剤、溶媒の種類及び量等を確認する必要がある。ブランク値測定用の試料溶液も同様に操作を行う。
32 硫酸の添加操作は、硫酸と有機物の反応による発熱のため、溶媒の突沸が起こることがあるので十分注意する。飼料の種類にもよるが、試料 100 gを抽出した場合、抽出液が著しく着色し、少量の硫酸の添加ではヘキサン層と硫酸層との境界が不明瞭となる場合が多い。このため、初めに 40~50 mL程度の硫酸を滴下し、一晩程度放置してヘキサン層を透明にした後、硫酸層に存在するタール状物質を流下する方法が有効である。その後 10~15 mL程度の硫酸を添加して振とうし、硫酸層が着色しなくなるまでこれを繰り返す。
33 硫酸処理により得られた試料溶液を多層シリカゲルカラムに供する場合は、10%硝酸銀シリカゲル 3.0 gの上にシリカゲル2.0gを充てんする必要がない場合がある。
34 市販の充てん済み多層シリカゲルカラムとしては、ガラス製多層シリカゲルカラム(SUPELCO製)、プレセップ多層シリカゲル(和光純薬工業製)がある。
35 各充てん部が下端まで著しく着色している場合は、新たに多層シリカゲルカラムを作成し、同様の操作を繰り返してもよい。この場合、必ずしも全ての層を積層する必要はない。
36 洗浄液量が多いと、2,3,4,4',5-PeCB (#114)が流出し特異的に回収率が低下する。クリーンアップスパイク用内標準物質に 13C12-2,3,4,4',5-PeCBを使用していない場合は定量値を過小評価することになるため、可能な限り少量のヘキサンで洗浄する。
37 簡易的に極性物質を除去するために使用する。試料によってはソックスレー抽出/硫酸処理の後、多層シリカゲルカラムクロマトグラフィーの替わりに使用することができる。また、アルカリ分解後、DMSO抽出/ヘキサン逆抽出を行う場合に、試料溶液を濃縮する際の析出物の除去にも有効である。
38 硫黄分を除去するために使用する。
39 脂質等の除去に有効である。本操作後は、多層シリカゲルカラムクロマトグラフィーを行うか、硝酸銀シリカゲルカラムクロマトグラフィーを行う必要がある。
40 アルミナの活性は製造ロットや開封後の保存期間及び方法によって変化する。活性の低下したものでは、1,3,6,8-TeCDD及び 1,3,6,8-TeCDF等が第 1画分に溶出する。また活性の高いロットにあっては、八塩化物が第 2画分に溶出しきれない場合がある。これらについては分画試験で確認する。また、モノオルト Co-PCBs及びノンオルト Co-PCBs・PCDD/DFsの分離が十分でない場合、抽出液又は硫酸処理の段階で分割し、2本のアルミナカラムにより操作する必要がある。
41 HPLC用活性炭カラムとしては、Shandon製 Hypercarb S(porous graphitized carbon)がある。
42 窒素気流下による濃縮作業では、溶液の表面が動いているのがようやく見える程度に窒素気流を調節し、溶液が飛散しないようにするとともに、乾固させないように注意する。溶液に渦ができるほど窒素を吹きつけ、又は乾固させると、ダイオキシン類の損失を招くことがある。
43 極少量の一定量(20 µL程度)まで濃縮し,最終液量までノナンを加えてもよい。また、極少量の溶媒が残る程度まで濃縮した後、シリンジスパイク用内標準液で定容する方法もある。
44 試料溶液に着色がなく、不揮発性成分が目視で確認できない状態まで、十分に精製されていることが望ましい。必要ならば再精製を行う。着色や残留物が認められる場合は、キャピラリーカラムにおける成分の分離能の低下、装置のイオン源の汚染に伴う感度変動等による精度の低下、さらに PFK等の校正物質による正確なチューニングの妨害等の原因となる。
45 キャピラリーカラムによって得られるピークの幅は、5~10秒程度であるが、ピークを構成するデータポイントを確保するためには、SIM法における周期を 1秒以下にしなければならない。1回の分析で設定可能なモニターチャンネルの数は、要求される感度との兼ね合いとなるので、十分に検討した上で設定する必要がある。
クロマトグラム上の各ピークの保持時間を考慮して、時間分割によるグルーピング方式によって分析しても良いが、この場合には各グループについて、適切な内標準物質ピークが出現するように、条件の設定を行う必要がある。
46 ノイズ幅(N)及びピーク高さ(S)は一般に次のようにして求める。まず、ピークの近傍(ピークの半値幅の 10倍程度の範囲)のノイズを計測しその標準偏差の 2倍をノイズ幅(N)とするか、経験的にノイズの最大値(E1)と最小値(E2)との幅は、およそ標準偏差の 5倍となるため、その幅の 2/5をノイズ幅(N)とする。一方、ノイズの中央値(C)をベースラインとし、ベースラインのノイズを元にピークトップ(D)を決めて、この幅をピーク高さ(S)とする(下図参照)。
47 この濃度範囲は定量下限値近傍の低濃度を含み、GC/MSのダイナミックレンジ内でなければならない。
48 定量は、2つのイオンのピーク面積値の平均又は主要ピークの面積を使って行う。
49 JIS等環境測定に関する定量法では 5%以内と規定されているが、本ガイドラインでは、標準液の濃度が低いこと及び測定毎に検量線を作成することから許容幅を大きくしている。GC/MSを適正に保守管理していれば、通常 10%を超えることはない。
50 2,3,7,8-位塩素置換異性体は、得られた SIMクロマトグラム上のピークの良好な分離とともに、保持時間が標準物質とほぼ同じであり、対応する内標準物質との相対保持時間も標準物質と一致することで同定を行う。また標準物質のない異性体の同定については、文献などを参照して同定する。
SIMクロマトグラム上の、2つのモニターイオンのピーク面積比が、標準物質のものとほぼ同じであり、同位体の天然存在比(表 2-6)に対して ±15%(検出下限値付近の濃度によっては ±25%)以内であれば定量する。天然存在比から逸脱した場合であって、保持時間等から分析対象物質であることが確実なピークについては、2つのモニターイオンのうちの一方がノイズの影響を受けていることが明らかに認められる場合に限り、もう一方のモニターイオンにより定量する。
51 ロックマスチャンネルの SIMクロマトグラムが波を打つなどの変動があった場合で、特に分析対象物質の出現位置において、この現象が認められた場合には、正確にピークをとらえていない可能性があり、大きな精度低下が生じているため、その成分については定量してはならない。主な要因として、試料溶液の精製が不十分であることが考えられるので、当該 GC/MS試料溶液を再精製するか又は再分析を行い、ロックマスの変動を最小限に抑える必要がある。
52 2,3,7,8-位塩素置換異性体の定量は、対応する標準物質を用いて行う。その他の異性体を定量する必要がある場合には、各塩素数における 2,3,7,8-位塩素置換異性体と同じ感度を持つものとして計算する。
53 クリーンアップスパイクの回収率が、40%以上 120%以下の範囲から外れるときは、原則として前処理操作から再分析する。
54 特定のピークが妨害を受けた時、原則としてそのデータは使用できないが、そのピークの分析値に対して操作ブランク値が 30%以下であれば、そのデータを使用してもよい。
55 通常、残留実態を把握する目的で実施する分析では、定量下限値を超えて検出された異性体を毒性当量に換算し、それらを合計して、検出されたダイオキシン類を毒性当量として算出する。リスク(摂取量)の評価を行う場合においては、検出下限値を超えて検出された異性体を毒性当量に換算すると同時に、試料中に検出下限値未満の異性体が含まれる可能性を考慮して、未検出異性体について検出下限値に 1/2等の係数を乗じ、それらも合計して毒性当量を見積る方式がある。
56 ブランク試験は、試料溶液の調製又は GC/MSへの導入操作等に起因する汚染を確認し、試料の分析に支障のない分析環境を設定し、分析値の信頼性を確保するために行うものであり、試料の分析と同時に行う。
ブランク値を飼料中の濃度に換算した値が、目標定量下限値を超える場合には、器具の再洗浄や機器の調整を行ない、ブランク値の低減に努める。
57 排ガス、フライアッシュ等、高濃度汚染試料を分析する分析室においては、高濃度試料を扱うエリアと飼料等の低濃度試料を扱うエリアとを更に分割することが望ましい。共用の実験室を用いる場合は、飼料等の分析を行っている期間は実験室内に排ガス、フライアッシュ等、高濃度汚染試料を持ち込まないこと等によりブランク値の低減を確保する。






